Neuroimmun-vaskuläre Wechselwirkungen bei der Alzheimer-Krankheit
Matteo Rovere – Hector Fellow Christian Haass
Die Alzheimer-Krankheit (AD) hat eine multifaktorielle Ätiologie, die unter anderem eine vaskuläre Dysfunktion und eine aberrante Neuroimmunität umfasst. Unser Ziel ist es, das Gen ABI3 als mögliche Verbindung zwischen diesen beiden Aspekten der Alzheimer-Pathophysiologie zu untersuchen. Mithilfe transgener Mausmodelle und einer Kombination aus biochemischen, immunhistochemischen und In-vivo-Bildgebungsverfahren werden wir untersuchen, wie sich die AD-Risikovariante S209F ABI3 auf die Neurodegeneration, die Immunkompetenz und die Gefäßdynamik auswirkt.
Die Alzheimer-Krankheit (AD) ist die häufigste Ursache für Demenz und stellt eine große gesellschaftliche und wirtschaftliche Belastung dar. Trotz jüngster Durchbrüche gibt es immer noch kein etabliertes Therapieschema, das die Krankheit stoppen oder umkehren könnte. Angesichts des komplexen multifaktoriellen Charakters der Demenz haben Arzneimittelkombinationen das größte Potenzial, diese Ziele zu erreichen, und unter anderem sind die vaskuläre Pathologie und die neuroimmune Dysfunktion vielversprechende Ziele, die sich noch außerhalb der therapeutischen Reichweite befinden.
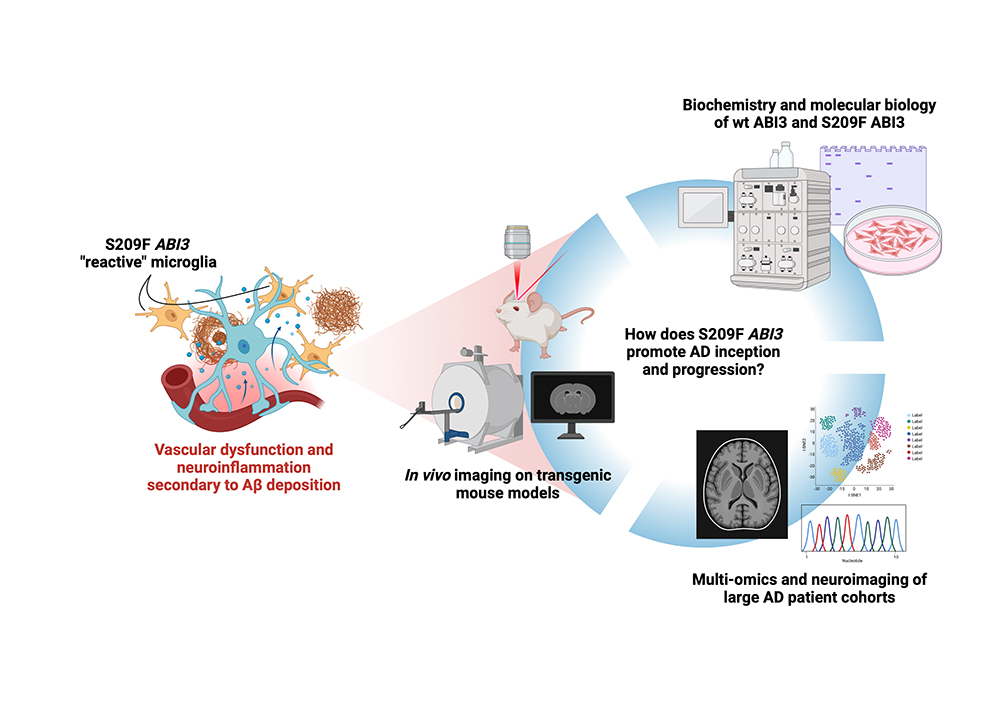
Wir interessieren uns für das ABI3-Gen, dessen S209F-Variante mit einem erhöhten Risiko für die Entwicklung von Alzheimer im Spätstadium verbunden ist. Vorläufige Arbeiten haben gezeigt, dass transgene Mäuse, die das murine Analogon von S209F ABI3 tragen, mikrogliale und neurovaskuläre Anomalien aufweisen, und wir glauben, dass dies ein Weg sein könnte, durch den diese scheinbar unabhängigen Krankheitsmechanismen synergistisch wirken. In diesem Projekt wollen wir die Biochemie und Molekularbiologie von ABI3 in gesundem und krankem Zustand charakterisieren und durch den Einsatz von transgenen AD-Mausmodellen seine Auswirkungen auf das Fortschreiten der Neurodegeneration, die Neuroimmunreaktionen und die Gefäßdynamik im Detail untersuchen. Wir werden eine Kombination aus Biochemie, Immunhistochemie an Maus- und menschlichem Gewebe, In-vivo-Bildgebung von Mikroglia-Motilität und Gefäßreaktionen sowie Multi-omics an großen Patientenkohorten einsetzen.
Insgesamt könnte unsere Arbeit nicht nur dazu beitragen, neue translationale Targets zu identifizieren, sondern auch die Annahme klinischer Interventionen (z. B. vasoprotektive Maßnahmen) für Demenzpatienten zu unterstützen.
S209F ABI3 Knock-in und Knock-out transgene Mäuse zeigen neurovaskuläre Defekte und Veränderungen der mikroglialen Verzweigung und Motilität. Unser Projekt zielt darauf ab, die molekularen Mechanismen hinter diesen Phänotypen durch eine Kombination aus Biochemie und Molekularbiologie, In-vivo-Bildgebung an transgenen Mausmodellen sowie Multi-omics- und Neuroimaging-Daten zu identifizieren, die an großen AD-Patientenkohorten erhoben wurden.

Matteo Rovere
Ludwig-Maximilians-Universität MünchenBetreut durch

Christian Haass
Medizin