Mehrdimensionale Modellierung von angeborenen Fehlern der Hämatopoese in einem neuen dreidimensionalen menschlichen Knochenmark-Organoid-Modellsystem
Megha Varghese Mukherjee – Hector Fellow Christoph Klein
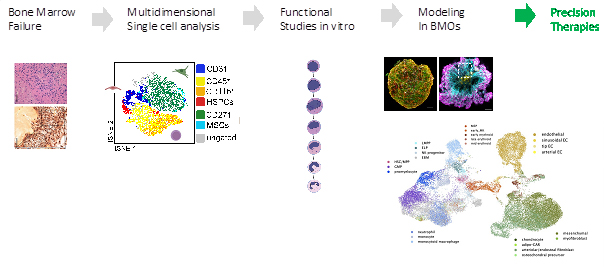
Schwere kongenitale Neutropenie (SCN) ist eine genetische Störung der Hämatopoese, zu der mehrere Gene beitragen oder die Krankheit verursachen. Defizite in VPS45, SMARCD2, HAX1 und ELANE führen zu kongenitaler Neutropenie. Durch die Verwendung von CRISPR-Cas9 zur Einführung von Funktionsverlustmutationen in diesen Genen können wir untersuchen, ob Knochenmarksorganoide den Phänotyp dieser Fehler nachahmen können. Ich werde feststellen, ob sie zur Untersuchung von Aberrationen wie Fibrose bei diesen Fehlern verwendet werden können, indem definierte pro-fibrinogene Wege gehemmt werden, mit dem Ziel, die kritischen Faktoren aufzuklären, die zu einer Dysfunktion des Knochenmarks führen. Schließlich werde ich herausfinden, wie diese Multi-omics-Analyse auf Einzelzellbasis in innovative Diagnostik umgesetzt werden kann. Mein Promotionsprojekt zielt darauf ab, morphologische Daten von primären Knochenmarkausstrichen und Knochenmarkorganoiden (BMOs) mit genomischen und transkriptomischen Datensätzen zu korrelieren.

Megha Varghese Mukherjee
Ludwig-Maximilians-Universität MünchenBetreut durch

Christoph Klein
Medizin & BiologieHector Fellow seit 2013